Q18 キレート滴定法で行う硬度分析. q17 電解水をよう素滴定法で分析する原理. q10 塩化亜鉛水溶液に塩酸を少量加え,亜鉛板と銅板を接触させて入れて高温を保つと,銅に亜鉛が析出する理由.PH=7・・・・中性 pH7・・・・塩基性 5) 緩衝液(Buffer solution)は試料溶液のpHを決められた値に保つための試薬である。 6) キレート滴定に用いる試薬を作るときの純水は、金属イオンを含まないことが必要である。33.キレート滴定 キレート滴定では、金属イオンとキレート試薬(もっぱらedtaが使われる)が安定な錯体を作ることを利用する。 したがって、たとえば ebt の場合は滴定の終点として、完全に赤みの消えたところを取る。 キレート滴定では、ph の設定に
水の硬度測定 キレート滴定
キレート滴定 phを一定に保つ理由
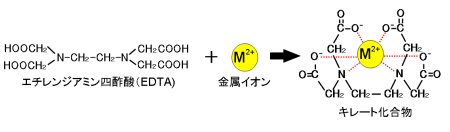
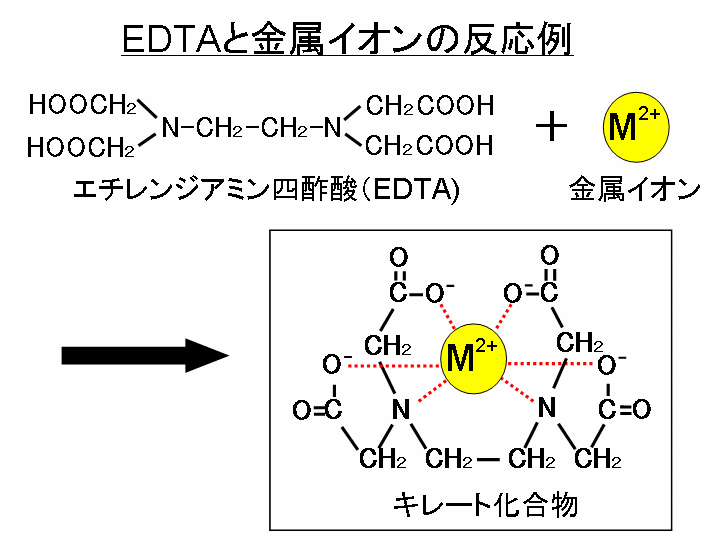
キレート滴定 phを一定に保つ理由-以上のことからphが ひくくなるとhの 濃度増加 のためedta錯 塩が不安定になり,phが 高くなると水 酸化物生成のためedta錯 塩の分解がおこり, edta 錯塩が安定なのは一定のph領 域に限られていることが わかりますそ してそのph領 域は金属イオンの種類に滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch2


質問箱
まず EDTA が直接的にキレート生成にかかわるのは四価の負イオンとしてであるが、pH が低くなると四価の負イオンとして溶存する量が減少し、キレート生成が押さえられるようになる。「キレート滴定」に関連する疑問をYahoo!知恵袋で解消しよう! キレート滴定でphを一定に保つ理由がわかりません。 滴定に際して反応の 有効安定度定数 を一定にする必要が在るから。 例えば金属イオン M^2 を EDTA (H4Y) で滴定する場合、 絶対安定度定数水の硬度測定 1 はじめに 硬度 1) とは,水に含まれるCa 2 とMg 2 の量を表す指標であり,この値に基づいて軟水や硬水 2) といった水の硬さが決められている。 軟水は口当たりがまろやか,硬水は苦みのような口当たりといわれている。近年,スーパーなどで多くの種類のミネラルウォーターを
カルシウム塩のキレート滴定について 一般財団法人 食品分析開発センターSUNATEC 第一理化学検査室 シェア Tweet 1 はじめに カルシウムは骨や歯を形作る重要なミネラルであり、自然界にも様々な形で存在する。 カルシウム量を求める方法は原子吸光より正確なpH測定を行うには、さまざまな注意点があります。その場合は、以下の解説を参考にしてください。 1 pH測定と液温について 溶液のpH値は固有の温度特性を有します。pH測定は、できるだけ正確な温度管理が必要です。40 <pH <78 となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな
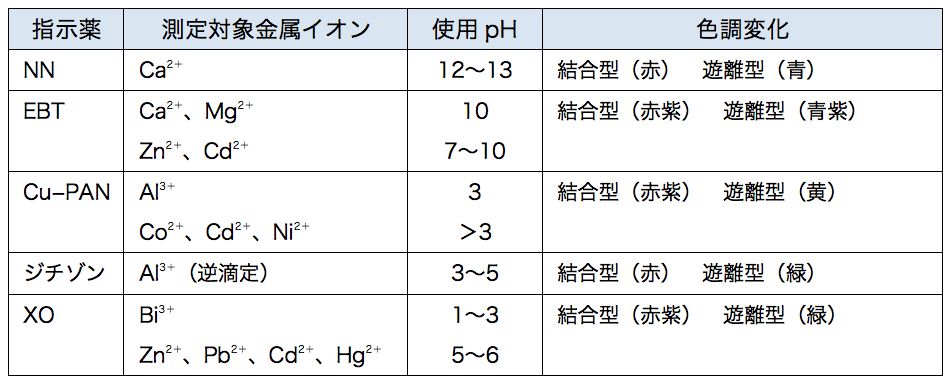
鉄イオンなどは、pHが2程度の酸性溶液でキレート滴定します。 これは、pHが高くなると、水和している鉄イオンがオール化してキレート反応しにくくなるからです。 オール化とは、鉄イオンに配位結合している水分子から水素イオンがとれて OH になり、この鉄イオンについた OH がもう一つの鉄イオンについている OH と結合して安定な多核体を作るからです。 上野質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法キレート滴定に用いられる主な金属指示薬を以下に示す。 金属指示薬については、目的金属イオンとEDTAとのキレート形成に最適なpHで変色する指示薬を選択する必要がある。 3 医薬品の定量 <例:塩化カルシウム水和物(CaCl 2 ・2H 2 O:)の定量>


1 水質


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋
一定時間毎に懸濁液を駒込ピペ ットにとり,直 ち にglass filterで吸引濾過する。かくしてこの濾 液中のEDTAと 結合しているCa〓 量を測定す ることにより脱灰過程を追求した。 Ca升の測定は大森に従つてキレート滴定法を用 い,次 の如く行つた。日本大百科全書(ニッポニカ) pH調節(ピーエイチちょうせつ)の用語解説 動物の体液中の水素イオン濃度(pH)はきわめて低いが、その値はごく狭い範囲内に一定に保たれている。これをpH調節という。ピーエイチと読むのは英語であり、ドイツ語ではペーハーとなる。キレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) 溶液のpHで変化する 温度が一定で分子形の溶解度は一定 溶液のpHにより変化しない 飽和溶液の上清の濃度 g/dL、mol/L pH変化
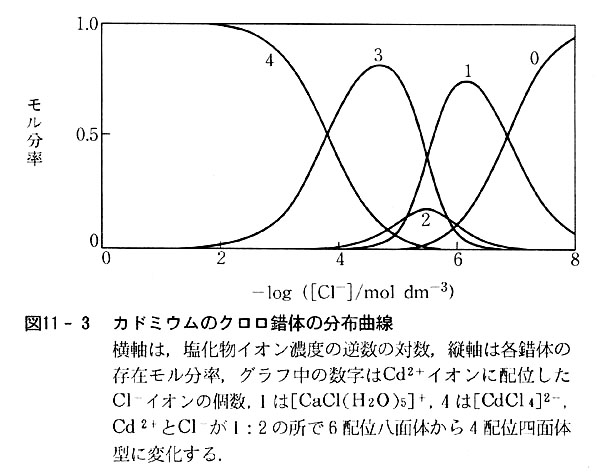


第11章 金属錯体


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋
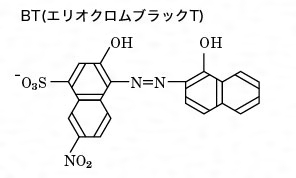
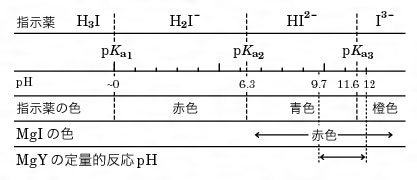
キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63キレート滴定に用いられる主な金属指示薬を以下に示す。 金属指示薬については、目的金属イオンとEDTAとのキレート形成に最適なpHで変色する指示薬を選択する必要がある。 3 医薬品の定量 <例:塩化カルシウム水和物(CaCl 2 ・2H 2 O:)の定量>滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch2



輸液製剤 Pdf Free Download


1 水質
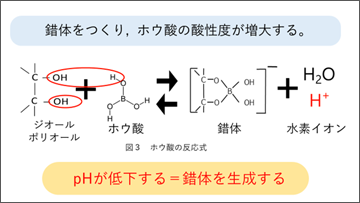
Dna分解酵素阻害剤としてのキレート剤 dna分解酵素であるdnaseは,その活性発現にmg 2 を必要とします. そして,teのバッファーの "e" は, edta のことです. dnaの保存で teバッファー を使う理由は以下の2点です. ・phを塩基性に保つことで,dnaを脱プロトン化して沈殿するのを防ぐ.蒸発乾固する。 (3) この残査の水溶液に一定過剰の edta標準溶液を加えて煮沸したのち,過剰の edtaをth(n03入標準溶液でxo を指示薬として逆滴定する。滴定法では原報2) のph調節のしか生成し、この塩酸がアルカリで間接 的に中和滴定される。 15 ℃に保つ理由は塩 酸の揮散を防ぐためである。この 種の滴定は、電離度が低くアルカリとの反応速度が遅い 酸に対して、終点が明瞭かつ反応速度が速くなるという 利点がある。 H 3PO 4 2NaCl →Na



輸液製剤 Pdf Free Download



本文 全ページ 540kb程度 Manualzz
生成するという性質は、edta を用いるキレート滴定法の汎用性を意味すると同時に選択性に乏しいことも意味している。 したがって、 2種以上の金属イオンが共存する場合、その中の特定の一成分だけを滴定するためには、適当な pH 領域を選択したり、隠蔽4.キレート滴定 41 001Medta標準溶液の調製 要点 キレート滴定において標準溶液として用いられるedtaは、普通edtaの2ナトリウム 塩h2na2y・2h2oでetaと表示されている。この試薬は結晶水以外に多少の水分を含んで理由1:金属イオンとキレートが結合する強さ(安定度定数)は、pHによって変化する。 pHが低いほど結合は弱くなるので、できれば高pH域でやりたい。 理由2:しかし、金属イオンはpHが高くなると水酸化物の沈殿になり、キレート滴定できない。 水酸化物が出来ないpH領域でなければならない。 理由3:キレート剤は酸であり、金属イオンと結合する際、水素イオン


キレート滴定とは コトバンク


水の硬度測定 キレート滴定
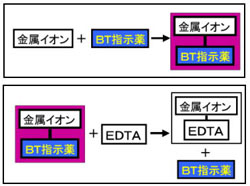
(5) 滴定・終点操作 (ア) 手際よく滴定操作ができている。 (イ) 終点の判断が適切である。 3 完成度・結果について 1 報告書 (1) 反応式・計算式など必要なものが記入されている。 (2) 反応式に基づいた計算が正しくされている。 (3) 誤差を考慮している。全硬度の測定は、試料水のpHを約10に調整した後,BT指示薬を加えて、EDTA溶液で滴定して求める。 BT指示薬はpH10付近では青色を呈するが、Ca 2+ 、Mg 2+ などの金属イオンを含む溶液中に加えるとキレート化合物を生成し、赤紫色を呈する。緩衝溶液 (または緩衝液;buffer) 外から少量の酸や塩基を加えても,また,希釈して濃度を変えても,その影響を緩和してpH(水素イオン指数)をほぼ一定に保つはたらき(緩衝作用)をもつ水溶液を緩衝溶液という。 一般に,酸性の緩衝溶液は弱酸と


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋


キレート滴定 Yakugaku Lab
キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63


水の硬度測定 キレート滴定


キレート滴定のレポートでキレート滴定では緩衝液を加え液のphを一定に保つ Yahoo 知恵袋



輸液製剤 Pdf Free Download



1994 2815号 鉄イオンの価数別分析方法 Astamuse


キレート滴定とは コトバンク


山大学温泉研究所報告


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋


容量分析の周辺


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋



3年次


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋


1 水質



水の硬度測定 キレート滴定



1996 号 m アルカリ度の測定方法 Astamuse


1 水質


質問箱



宮城県仙台第三高校 19さが総文 みらいぶ 高校生サイト


大至急 実験の考察について質問です 1週 Yahoo 知恵袋


質問箱


質問箱



キレート滴定 Yakugaku Lab



I へ 1 F 22 1 B 1 0 騨劉 1j 11 菫驍 二あたごで 籟轌鱗鞠菖 Lif 風 胸 量 一躍 1 L 丸 迄渋澤 11 齢哩醇 13 琴


宮城県仙台第三高校 19さが総文 みらいぶ 高校生サイト


1 水質



1994 2815号 鉄イオンの価数別分析方法 Astamuse



輸液製剤 Pdf Free Download


1 水質


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋


キレート滴定のedat溶液の標定においてアンモニア緩衝液を使用した Yahoo 知恵袋



第11章 金属錯体



もくじ Ph Phとは Phの測定原理 校正と測定 電極のメンテナンス サンプルに適した電極選択 16 Horiba Ltd All Rights Reserved 2 Pdf Free Download


クリスチャン分析化学i 丸善出版 理工 医学 人文社会科学の専門書出版社


亜鉛 とedta Y4 のキレート化合物の生成定数は以 Yahoo 知恵袋


キレート滴定行ったのですが 緩衝溶液を入れる理由が分かりません Phの変化 Yahoo 知恵袋



Jpa Stable High Protein Concentration Formulation Of Human Anti Tnf Alpha Antibody Google Patents
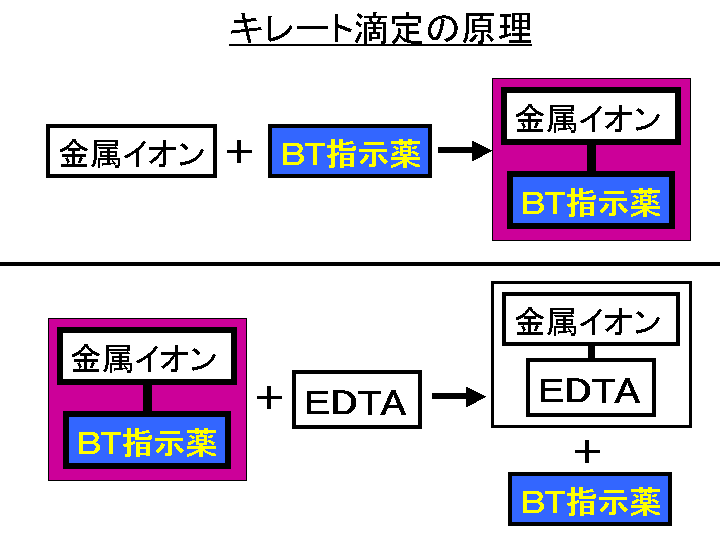


水の硬度測定 キレート滴定



1994 2815号 鉄イオンの価数別分析方法 Astamuse



1996 号 m アルカリ度の測定方法 Astamuse
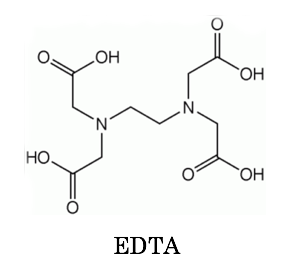


キレート滴定 Yakugaku Lab


1 水質


すぐできる なるほど ザ 化学実験室 日本分析化学専門学校


キレート滴定において カルシウム硬度測定の際 Ph 13付近にするため 水 Yahoo 知恵袋



0 件のコメント:
コメントを投稿